 2020-09-15 11:43:07 来源:投资家网专栏 作者:优选资本 赵铁
2020-09-15 11:43:07 来源:投资家网专栏 作者:优选资本 赵铁 摘要:炎症性肠病(IBD),主要包括溃疡性结肠炎(UC)和克罗恩病(CD),是一组慢性、特发性、异质性肠道炎症性疾病,在世界范围内尤其欧美地区影响非常广泛。该领域近年来上市了多款重磅药物,并且大量在研产品也即将进入市场。IBD药物治疗格局正在迅速发生改变。那么究竟有哪些改变?变化的趋势是什么?biotech公司在立项上该如何应对?本文将根据我们收集的资料以及以往的项目经验尝试对这些问题进行回答。
作者:优选资本 赵铁
炎症性肠病(IBD),主要包括溃疡性结肠炎(UC)和克罗恩病(CD),是一组慢性、特发性、异质性肠道炎症性疾病,在世界范围内尤其欧美地区影响非常广泛。该领域近年来上市了多款重磅药物,并且大量在研产品也即将进入市场。IBD药物治疗格局正在迅速发生改变。那么究竟有哪些改变?变化的趋势是什么?biotech公司在立项上该如何应对?本文将根据我们收集的资料以及以往的项目经验尝试对这些问题进行回答。
中重度IBD治疗加速进入以生物制剂为核心的时代
如果说20多年前Infliximab(IFX)获批,已经意味着IBD治疗进入生物制剂时代,那么近些年随着各种anti-TNFα,Natalizumab,Vedolizumab,Ustekinumab以及Tofactinib(小分子靶向药物)获批用于IBD治疗,临床上已经需要选择单抗药物进行应用。不仅如此,还要考虑单用还是联用,是否需要早期应用生物制剂进行治疗等问题。
尽管证据级别非常低,AGA(American Gastroenterological Association)在今年1月新鲜出炉的《中至重度溃疡性结肠炎的管理临床实践指南》已经建议在中重度UC患者中早期使用生物制剂,而不是逐渐升阶梯治疗。这似乎吹响了某种决战的号角,中重度IBD的治疗正在加速进入以生物制剂为核心的时代。

AGA建议在中重度UC患者中早期使用生物制剂
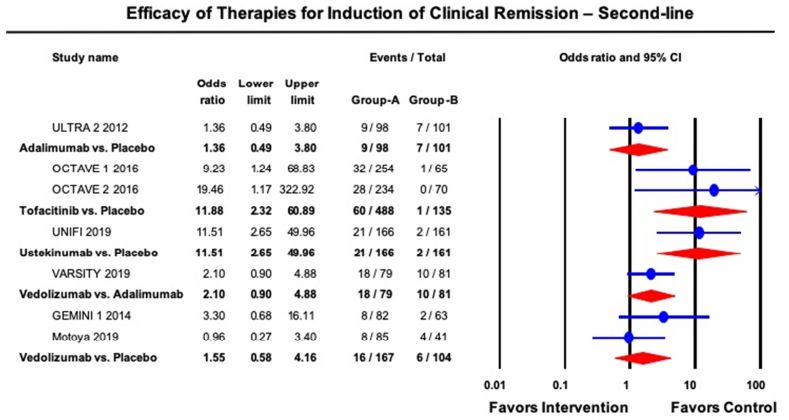
AGA在发布UC管理指南的同时伴随发布了相关技术综述,对已上市多种生物制剂及Tofactinib进行了疗效和安全性的比较。由于大部分为非头对头试验的结果,所以计算缓解率时需要合并安慰剂组并采用多种统计方法包括network meta-analysis等。该技术综述还纳入了2019年下半年最新公布的vedolizumab vs Adalimumab的头对头试验[VARSITY]以及UST的RCT试验[UNITI]的结果。最终疗效的比较结果为指南推荐的一、二线生物制剂提供证据支持。AGA指南推荐的详细内容这里不详细介绍,有兴趣可以参考文后的参考文献。
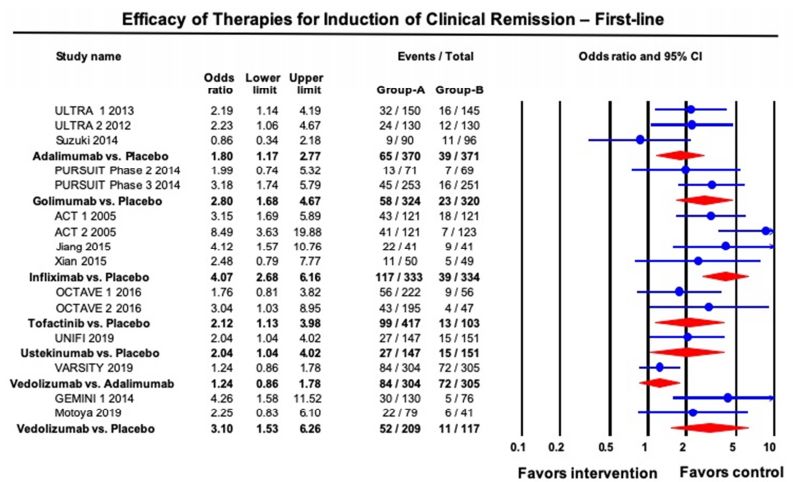
(上)中重度UC一线诱导缓解治疗的药物疗效(没有用过生物制剂的患者)Pair-wise meta-analysis
(下) 中重度UC二线诱导缓解治疗的药物疗效(用过anti-TNFα生物制剂的患者)Pair-wise meta-analysis
尽管有多个生物制剂上市,但仍然有较多未被满足的临床需求
在众多上市的生物制剂中,IFX仍然是一线治疗的首选,Vedolizumab和其他anti-TNFα以及Ustekinumab和JAK抑制剂由于各自的MOA不同、给药途径优势或成本效益比优势等原因也能占据部分患者群体。但从现有的临床数据看,中重度IBD能够得到完全临床缓解的比例大致在50%左右。而且达到临床缓解的患者依然面临一定比例的复发和耐药。
此外,安全性和依从性仍然存在较大未被满足临床需求。
安全性永远是慢性病用药追求的重要目标,即使生物制剂的副作用已经远比激素或免疫抑制剂等传统药物小。Vedolizumab虽然疗效没有头对头的与IFX的PK数据,但是从network meta-analysis结果来看,Vedolizumab较大可能不会超越IFX(可能也不敢去做这个头对头试验)。但是Vedolizumab的药理作用集中在肠道部位,明显降低了全身的毒副作用,因此获得了较好的临床地位。一个反面的例子是已经上市的Tofactinib。尽管Tofactinib具有新颖的MOA及一、二线较好的疗效,但仅仅在二线排在Ustekinumab之后获得AGA的建议。因此,安全性具有明显优势且作用机制差异化的靶向化药或生物制剂仍将获得较好的市场份额。
依从性对于IBD来说也是防止复发的重要因素。依从性一个主要的影响因素是给药途径。目前来讲,SC和PO较静脉注射有一定优势,同时也占据了成本-效益比的优势。用药频率低于每半月一次的SC和高于每天一次的口服药物很难说谁更有优势。阿达木单抗就是一个SC注射给药,而在IBD日益竞争激烈的格局中仍然占有一席之地的例子,即使是在Vedolizumab头对头比较优于阿达木单抗结果出来后,仍然有多位学者力挺阿达木的价值。Ustekinumab则直接开发成有SC给药剂型。这也是Vedolizumab希望上市皮下剂型 (108mg SQ every 2 weeks)的原因(但上市申请近期被FDA拒绝)。武田收购shire得到的SHP647也是直接做成SC给药,可见这是目前IBD领域的一个趋势。
尽管UC的治疗条件一直在改善,但UC患者的长期结肠切除率在过去十年中并未下降,这一事实凸显了对新型生物制剂及新机制药物的需求。
在研新药百花齐放,缓解临床需求,但加剧竞争
2019年4月Informa数据库的一项调查显示,47家公司在IBD治疗领域开展了70种上市前或后药物的临床研究,其中包括43种用于UC, 29种用于CD, 6种用于两种适应症。
目前上市和在研IBD治疗药物主流或常见的MOA包括抗细胞因子、抗粘附(包括T细胞归巢)、微生物制剂、干细胞再生、屏障修复剂、PDE-4抑制剂、JAK抑制剂、抗淋巴细胞等。
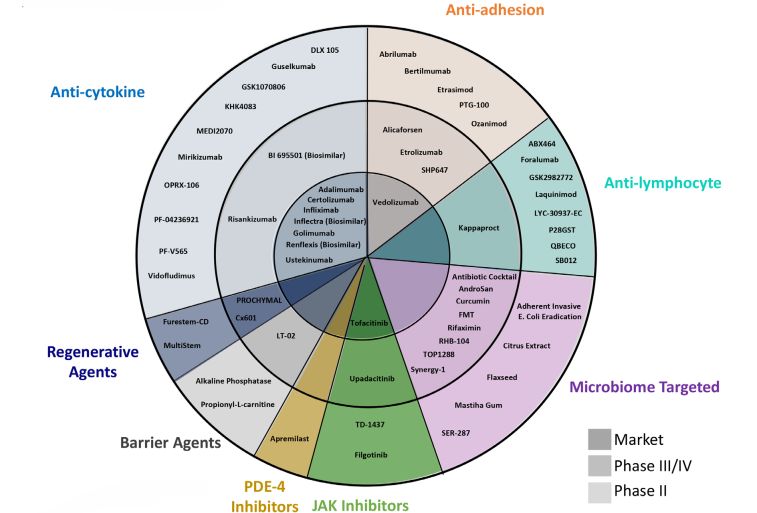
部分常见的上市和在研IBD治疗药物及MOA分类
抗细胞因子、抗粘附(包括T细胞归巢)、JAK抑制剂三种MOA已经有上市药物,并且仍在持续的开发或改良。比如,AJM300 (Carotegrast) (EA制药)是一种口服的小分子,针对α4整合素参与淋巴细胞归巢到肠道和大脑。UC的2期临床试验显示,与安慰剂相比,8周时临床反应、缓解和粘膜愈合率显著提高,但CD患者中没有观察到显著差异。Protagonist Therapeutics与Jassen合作利用其环肽技术开发口服肠道限制性的α4β7整合素拮抗剂PTG-100及下一代分子PN943,和同样为口服肠道限制性的IL23R(p19)抑制剂PTG200(JNJ-67864238)。PTG-100已经在UC患者中做过一个2a期临床,经过内镜重读后,临床缓解率为15.8%,组织缓解率为44%。PN943也已经完成了临床1期,即将开展2期研究,预期结果会优于PTG100。PTG200也即将进入临床2期。Theravance也与Jassen合作开发口服肠道选择性pan-JAK抑制剂TD1473(JNJ-8398),适应症包括UC和CD。1期结果显示UC患者系统暴露量明显降低,而结肠组织内浓度(80mg剂量)可以达到JAK抑制剂的IC50范围。这种对肠道的高度选择性,有望提高JAK抑制剂有效性和安全性。其他MOA药物仍在不断的探索,试图证明自己,但有不少都经历过了失败。不过我们还是可以看到一些希望。比如,粘膜修复剂中,尽管雀巢的LT-02(磷脂酰胆碱)以诱导缓解为目标的2期临床试验失败,但还是有理由推测凭借其安全性有希望成为已获得缓解的UC患者的维持治疗药物。虽然干细胞移植再生广泛应用还面对很多阻碍(如安全性),但仍相信未来它可能在IBD治疗中发挥重要作用。
其他部分在研的全新MOA或者改良药物基本情况如下:
Phase 1:
Aevi Genomics已经与Kyowa Kirin合作开发了AEVI-002,这是一种全人源单抗,它结合了一种在肠道组织中发现的被称为LIGHT的炎症蛋白。相关试验正在评估AEVI-002治疗儿童严重CD的疗效。
Assembly Biosciences正在对轻度至中度活跃UC患者进行活体生物药(live biotherapeutic product,LBP)候选药物ABI-M201的1b期临床试验。Assembly和Allergan已经开始合作,共同开发用于UC、CD和肠易激综合征的LBP化合物。ABI-M201是此次合作的第一个LBP候选药物。
Enterome与武田合作,共同开发和商业化一个first-in-class、非全身性的口服小分子EB8018(TAK018)。EB8018可以阻断细菌表达细菌毒性因子FimH(肠道炎症级联反应的关键诱导因子),从而减少CD患者的肠道炎症。EB8018治疗术后CD已经进入临床2期,活动CD的1b期临床试验也接近完成。
Gossamer Bio正在开发口服HIF-1α稳定剂GB004。2019年年第二季度开始进行活跃性轻度至中度UC 1b期研究的患者登记,公司预计2020年上半年公布研究的主要结果。
OSE Immunotherapeutics具有一个针对免疫肿瘤和自身免疫性疾病的药物管线。OSE-127是这条管线中的药物之一,它是一种靶向CD127受体(IL-7受体的α链)的单克隆免疫调节抗体,对效应T淋巴细胞产生强烈的拮抗作用。IL-7受体的阻断阻止了致病性T淋巴细胞的迁移,同时保留了对自身免疫性疾病有积极影响的调节性T淋巴细胞。第一批患者于2018年12月进行了1期试验。
Phase 2:
罗氏的另一款非免疫抑制疗法IL22-Fc蛋白已进入临床2期阶段。非临床研究证明IL22-Fc蛋白具有多重功能:它能够通过提高上皮细胞增生来刺激组织再生;提高黏液生产来加固肠道屏障;并且可以调节肠道菌群失调。在1期临床试验中,这款在研疗法已经表现出可以接受的安全性,并且在健康志愿者和UC患者中表现出剂量依赖性药物活性。
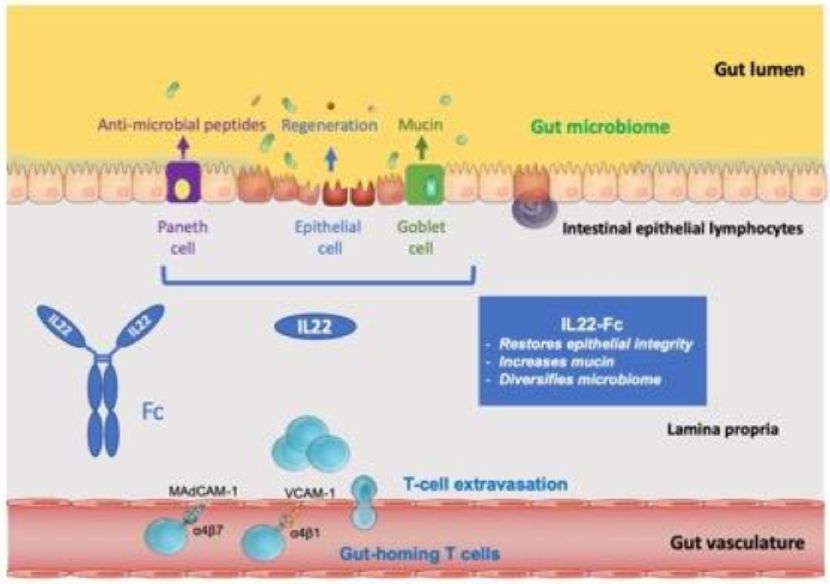
IL22-Fc蛋白作用机制
Bridge Biotherapeutics正在评估一种Pellino-1小分子抑制剂BBT-401。Pellino-1是一种连接酶,被视为多种免疫受体信号通路的关键介质。BBT-401在80名健康志愿者的1期研究中被证明具有良好的耐受性和安全性。此外,还有研究数据显示其没有或只有最少的全身暴露的关键特征。目前,一项随机、安慰剂对照、剂量递增的2期试验正在招募48名UC患者。
百时美施贵宝的BMS-986165是一种口服、选择性酪氨酸激酶2(TYK2)抑制剂。TYK2是一种细胞内信号激酶,介导细胞因子驱动的免疫和促炎症信号通路,在免疫介导疾病的慢性炎症循环中起关键作用。2018年银屑病患者的2期试验成功完成。目前正在进行两个2期试验,CD和UC各一个。
礼来公司正在研制mirikizumab(LY 3074828),这是一种人源化IgG4单抗,可结合并抑制IL-23的p19亚单位。克罗恩病患者2期SERENITY试验和UC 2期试验均报告阳性结果。两项试验均表明,与安慰剂相比,mirikizumab治疗的患者在12周时获得的临床缓解率和内窥镜检查症状减轻率显著提高。礼来目前正在进行CD和UC的2期和3期的临床试验。
Gilead与Galapagos NV合作正在研究一种高度选择性JAK1抑制剂filgotinib。2期研究FITZROY的结果于2017年12月发表在《柳叶刀》上。本研究探讨了filgotinib治疗活跃性中重度CD的疗效和安全性。数据显示,与安慰剂相比,filgotinib治疗后临床缓解患者明显增多,且具有可接受的安全性。目前有7个正在进行的2期和3期试验,包括MANTA、DIVERSITY、DIVERGENCE2和SELECTION1。
Immunic Therapeutics正在开发一种可抑制二氢硼酸脱氢酶(DHODH)的小分子药物口服片剂。Immunic在2017年完成了两项1期研究,评估了健康志愿者每天一次或重复使用IMU-838的剂量,研究结果支持每天重复给药高达50mg的IMU-838的耐受性。目前,Immunic的2期试验CALDOSE 1正在对UC进行研究。
Seres Therapeutics的SER-287是一种使用Seres专有的微生物治疗平台开发的口服胶囊。它属于生物来源,包含一个活的和多种细菌孢子的联合体。SER-287被设计用来减少免疫激活的触发而非抑制免疫系统。UC患者的1b期试验结果显示,SER-287微生物组治疗可提高临床缓解率和内窥镜诊断评分。2期试验ECO-RESET目前正在招募200名18−80岁患有活跃性轻度至中度UC的成年人。
Sublimity Therapeutics利用Sublimity专有的SmPill®给药系统开发出一种口服环孢素制剂,称为ST-0529。与传统口服或静脉注射环孢素不同,SmPill®技术能够将环孢素准确地直接输送到结肠病变组织中,从而最大限度地减少全身暴露和不必要的副作用。在一项2a阶段的研究中,ST-0529显示出良好的安全性和耐受性。一项2b阶段的研究AURORA(CYC-202)目前正在招募280名中度至重度UC患者。
随着新药的不断研发,IBD未被满足的临床需求一定会得到一定程度地缓解,但同时也会带来竞争的加剧。以抗粘附(包括T细胞归巢)药物为例:除Natalizumab、Vedolizumab、Etrolizumab,在研的SHP647和口服的α4β7小分子抑制剂等之外,还包括在研的ozanimod、etrasimod等一众S1PRa类药物。选手众多且具有相似的作用机理,竞争关系非常复杂。S1PR小分子激动剂相对抗α4β7抗体最大的优势就是可以口服,但S1PRa存在理论上的进行性多灶性白质脑病(PML)风险(尽管诺华报道芬戈莫德没有明显的PML),除非具有肠道特异性,否则将有可能受限于治疗窗,影响对IBD的疗效。而且α4β7靶点也正在开发口服小分子抑制剂,对S1PRa类药物不利。Natalizumab受到PML的限制基本已经退出了IBD的竞争,Vedolizumab暂时取得领先,但罗氏的Etrolizumab (RG7413/rhuMAb Beta7) 靶向β7亚单位,同时拮抗T细胞的归巢和驻留,有望进一步提高疗效。最近,在抗TNFα难治性CD患者的3期临床试验BERGAMOT中显示了早在6周和持续14周的比Vedolizumab更高的症状和内镜缓解率。而且Etrolizumab也同时开发了SC版本。很难说长效的SC版本和PO版本那个更具有优势,这更加剧了该MOA药物的竞争。
新药预期市场份额缩水,开发难度加大
IBD作为慢性病的特点是患病率较高但发病率一般,也就是存量病人较多,而新增病人不会太多(欧美高发地区每10万人的发病率CD>6.38,UC>7.7,患病率CD>135.6,UC>198)。IBD存量市场是兵家的必争之地,也是主战场。而诱导缓解仍然是该病的主要挑战,但一旦达到缓解,尤其是无激素缓解,该药物是否将持续作为缓解期用药?现有药物能够维持缓解期多长时间?现有药物又能够诱导多少患者进入缓解期?这些问题对分析IBD治疗的存量市场至关重要。
《clinical gastroenterology and hepatology》发表的一篇论文显示停用英夫利昔单抗会增加UC患者复发风险。目前,尚缺乏足够证据给出何时停用IFX的推荐意见。对IFX维持治疗达1年、保持临床无激素缓解、黏膜愈合、CRP正常者,可考虑停用IFX,继以免疫抑制剂维持。停药后复发患者重新给予IFX,80%患者可再次获得临床应答。
如下图所示,一项长期的随访研究告诉我们IFX单抗5年的复发风险约为25%,10年的复发风险约为50%,我们可以大致推出持续使用IFX5年的缓解率为75%,10年的缓解率为50%。
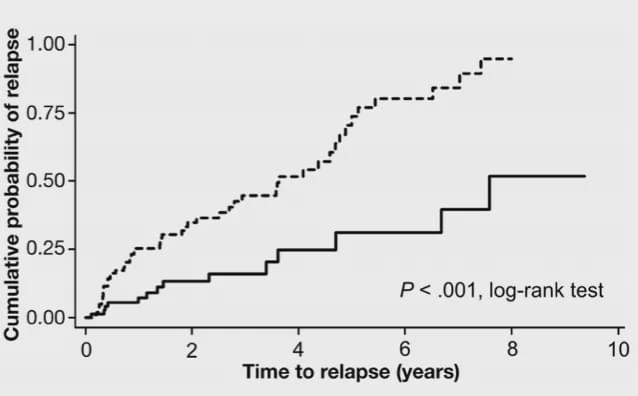
10年内停用和连续使用英夫利昔单抗复发风险的Kaplan-Meier曲线
其他生物制剂是否也能达到类似的缓解程度呢?由于Vedolizumab和Ustekinumab上市时间较短,暂未发现有超过5年的随访研究结果。
Ustekinumab有一项针对CD的3年随访研究。该试验入组患者近400人,临床缓解率从60%左右(由于0周时入组的患者是主要8w诱导缓解期结束时有响应的患者,因此缓解率起始就低于100%)下降至40%左右。表面上看Ustekinumab似乎维持缓解的效果没有IFX好,但实际上仔细剖析试验设计可以发现,该试验有近一半左右的入组患者(来自于UNITI-1研究)有anti-TNFα生物制剂难治性的历史。而从该试验结果中可以看出,这类患者在8周时诱导缓解率相对更低,44周时的维持缓解率也更低。因此,这部分患者是造成152周时缓解率下滑近三分之一的主要动力。如果剔除这部分患者,则剩下的入组患者(来自于UNITI2)44周时维持缓解率仅下降了6%左右,预期152w时下降不超过20%。这与IFX持续给药的维持缓解试验的结果近似。
其实,IFX复发的患者中还有一部分是因为产生了抗药抗体。但这部分患者可以通过优化药物剂量或者更换免疫原性更低的其它TNFα抗体,比如阿达木单抗重新获得缓解。
因此,如果说生物制剂的十年维持缓解率可能超过50%并不过分。也就是说,多数使用单个生物制剂达到临床缓解的患者可以维持5年以上的缓解,过半数可以维持10年以上的缓解。
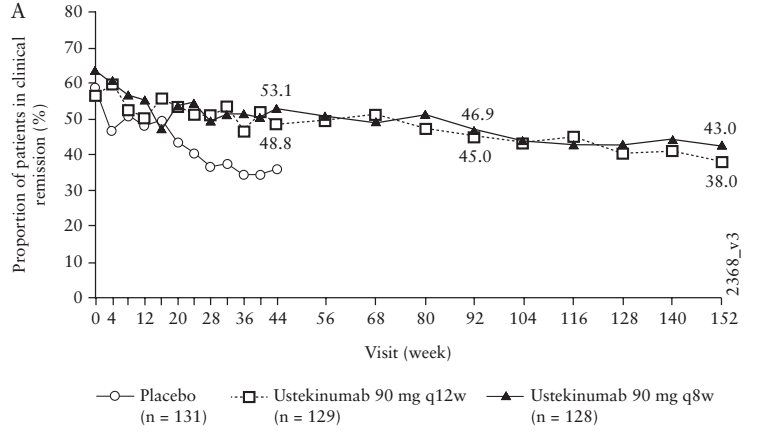
Ustekinumab治疗152周内CD患者诱导和维持临床缓解的患者比例
以IFX为首的anti-TNFα一线生物制剂可以诱导缓解约20-35%的IBD患者。接受二线Ustekinumab治疗(使用过anti-TNFα生物制剂)的CD患者中8周临床缓解率有20%左右(如下图所示,其中UNITI-1为2线使用Ustekinumab),而UC患者(使用过anti-TNFα的生物制剂约占一半)中8周临床缓解率为15%。经粗略计算后我们推出可以诱导接近40%左右的IBD患者达到临床缓解。再加上Vedolizumab、Tofactinib以及未来上市的Etrolizumab等,相信整体可以使50%左右的中重度IBD得到临床缓解,其中有部分可以实现无激素缓解。
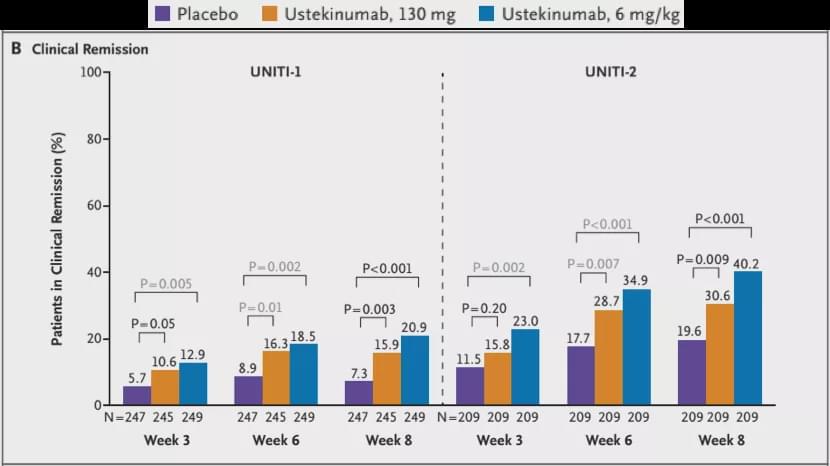
CD患者接受Ustekinumab治疗诱导临床缓解的比例
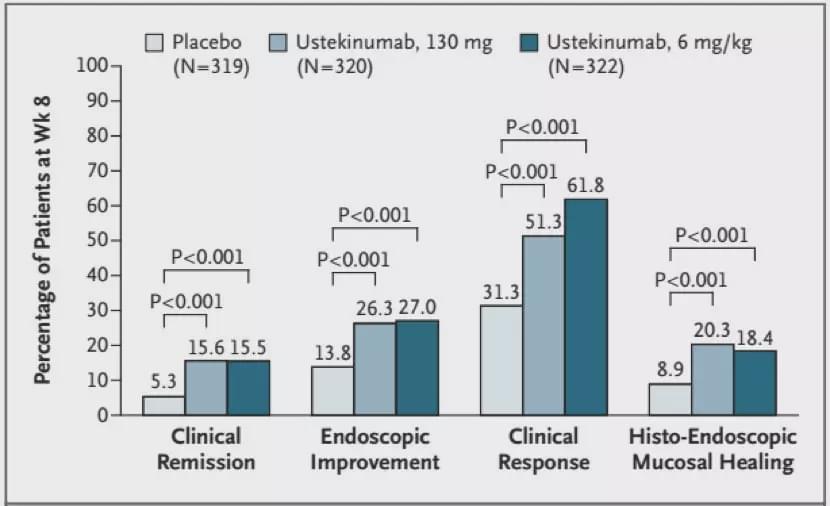
UC患者接受Ustekinumab治疗8周时临床缓解、内镜改善、临床响应和组织-内镜粘膜愈合的比例
如果把每一个IBD药物比作一张“渔网”,存量IBD患者比作一个鱼塘里面的“鱼”,则综合上述分析,每一个渔网会在这个鱼塘中捕捉到一定比例的鱼,并且5-10年只有较少的鱼会漏出渔网回到鱼塘。目前,这样的渔网可以捕捉到整个鱼塘中约50%左右的鱼。即使早期撒下的渔网已经有部分鱼漏出回到鱼塘,这部分鱼也很可能又被新的渔网捕捉到。因此,至少5年内,鱼塘内50%的鱼是被这些新老渔网捕获而不会轻易漏出回到鱼塘的。也就是说50%的市场份额至少在5年内很少释放出来。而随着更新的“渔网”撒进鱼塘,被这些渔网长期捕获的鱼比例继续增加是大概率事件。

除了市场份额已经开始逐渐减少,新药开发需要跨过的barrier也越来越高。仅考虑新MOA的产品(非安全性或给药途径改良产品或联合治疗定位的产品),如果想进入后线治疗,其临床试验的入组人群将至少是anti-TNFα、Vedolizumab或Etrolizumab治疗过无效、耐药或无法耐受的患者甚至是Ustekinumab或Tofactinib治疗过无效、耐药或无法耐受的患者,难度可想而知。如果想进入一线治疗(biologic naive),则大概率需要做与现有一线主要生物制剂的头对头临床试验,以获得充分的数据,从而获得临床医生的支持,才能在一线激烈竞争中获得一席之地。
IBD的发病机制非常复杂,新的MOA治疗药物屡遭失败。IL17和IL13单克隆抗体治疗,以及有效地利用IL10来直接调节免疫反应均未能成功,尽管有令人信服的证据表明所有这些细胞因子是参与IBD的炎症反应的。
IBD异质性也非常大。很难有新的MOA可以覆盖大量患者群体。而且随着研究的深入,生物制剂和靶向药物增加,在IBD领域精准医疗的概念也已经提出。这意味着根据易感基因、治疗响应、动态监测等进一步对患者群体进行分层的时代即将来临。大“渔网”(适应人群广泛的药物)的出现将变得越来越困难。
临床试验终点目标和招募难度水涨船高
受到各种条件的限制,临床试验的设计和结果与最终的临床应用场景及预后之间总会存在或多或少的gap。弥补这一gap需要不断的优化试验设计或补充更多的临床试验。当前,IBD治疗正朝着更好的预后发展。这需要不断优化治疗的临床评价标准。相应地,药物临床试验的终点指标也水涨船高。
以UC为例,近些年的RCT临床试验设计中,内镜、组织学、生物标记物以及PROs(patient reported outcome,主要包括患者生存质量评分)作为关键疗效和安全性结果的比例正在提高。
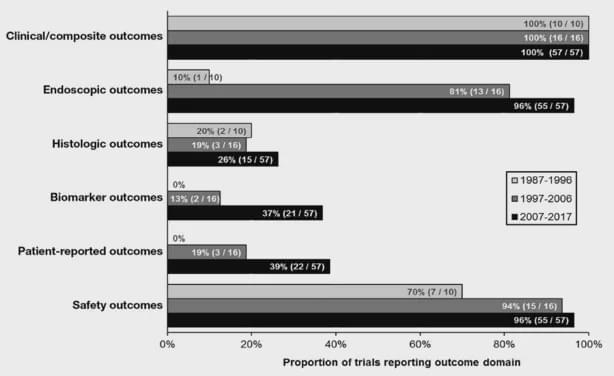
内窥镜终点几乎已经普遍作为当前RCT的评价结果。然而,粘膜愈合的准确定义仍然存在争议。虽然大多数RCT使用MCS子评分cut off值≤1, 但是目前仍不清楚严格的定义MCS评分为0的粘膜愈合是否与长期效果改善相关?(尽管近期的多项研究包括前瞻性队列研究显示Mayo内镜评分1分比0分的患者更容易在1年内发生疾病复发,回顾性研究显示Mayo内镜评分1分患者的复发风险是评分0分患者的3倍)。而这些定义反过来可能影响报告的有效率结果。除了内镜结果外,组织学终点也被越来越多地采纳。“深度缓解”,定义为伴随着组织学炎症消退的粘膜愈合,可能预测UC改善的长期预后。而且,FDA提出了这样的说法,只有在包含组织病理学评估结果的情况下,粘膜愈合才会被承认。但是,缺乏充分验证的设备或普遍接受的定义以测量组织学响应或缓解是在UC临床试验中应用组织病理评估的一个主要限制。去年10月,在获得治疗UC的上市批准后,强生宣布Ustekinumab是迄今为止第一个也是唯一一个以组织-内镜粘膜改善为终点评价肠道改善情况的上市UC治疗药物。组织-内镜粘膜改善被定义为内镜改善(Mayo内镜subscore 0或1)和结肠组织学改善(隐窝内性粒细胞浸润<5%,没有隐窝破坏,没有侵蚀,溃疡或肉芽组织)的组合。
内镜和组织学检查容易因其介入性而在临床使用受限。因此,以非介入性生物标记物作为治疗目标受到了追捧。最近十年超过三分之一的RCTs报道了生物标记物的结果,主要集中在粪卫蛋白(FCP)和C反应蛋白。FCP是一种可靠的粘膜炎症生物标志物,并可预测维持治疗期间的响应丢失。然而,以生物标志物为终点的“达标治疗(treat-to-target)”方法是否能改善UC的深度缓解仍有待进一步确定。
虽然目前内镜、组织学、生物标记物、无激素缓解等临床终点主要作为次要终点出现,而且其准确界定及对预后的意义仍需更大规模的前瞻性队列研究来证实,但“达标治疗”的趋势已不可逆转,2015年,STRIDE专家委员会确定了炎症性肠病(IBD)的“达标治疗”方案,将UC治疗的目标转变为预防长期疾病并发症(异形增生/癌变、住院治疗、结肠切除术),同时建议监测UC的客观疾病活动(如内镜炎症证据)。可以想象未来IBD治疗的临床终点中除了基本的临床缓解外,上述甚至更多的目标将日益被医生和FDA接受,成为预后和评价治疗药物的重要终点。
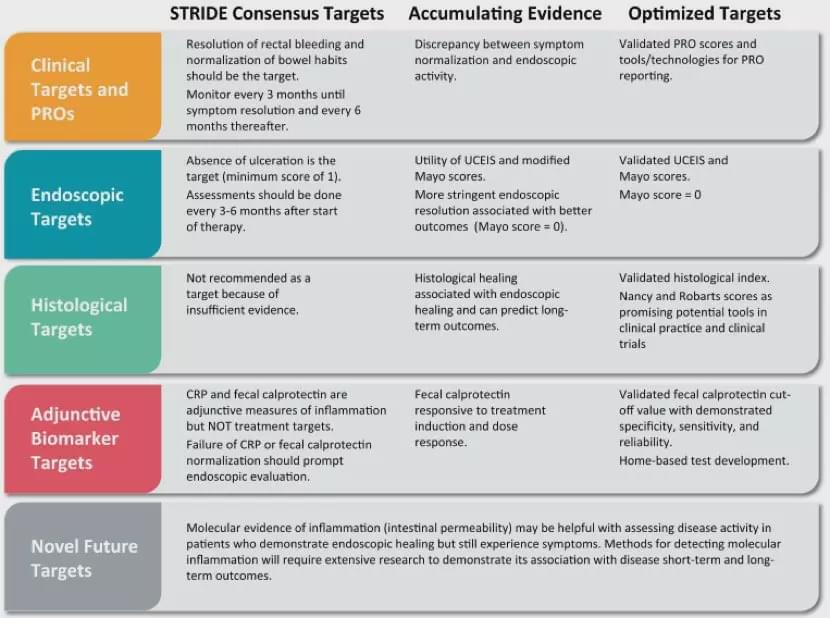
UC管理中累积的证据和特定目标的演进
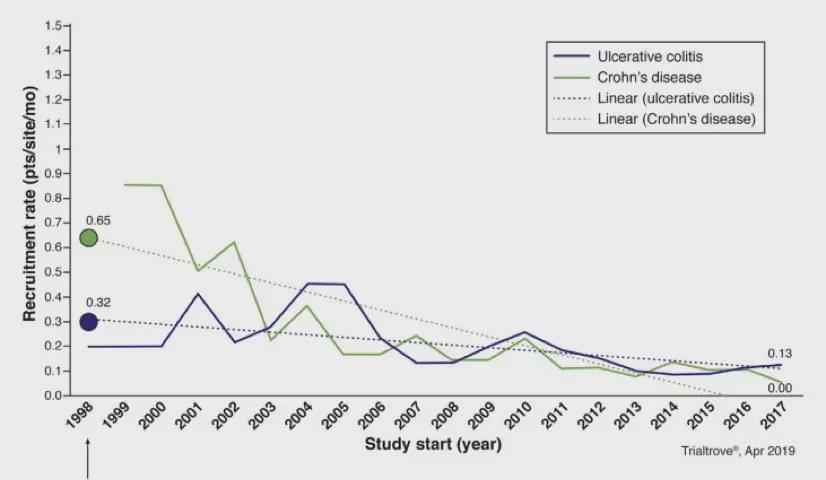
Informa的一项调查显示,自从IFX首次获批用于IBD适应症的20多年来(1998年以来),中重度UC每个临床中心的平均招募率为从0.32 降到0.13例/月,而中重度CD每个临床中心的平均招募率从0.65例降至0.0-0.10例/月(如下图所示)。1998年,总共有7次中重度IBD临床试验, 包括3个UC和4个CD;到2018年,已经增加到147个临床试验,包括84个UC和63个CD。这些趋势迫使制药公司不得不在全球范围内寻找可以参加IBD临床试验的中心。
分析原因可能包括:在研药物数量的增加;相对于加入临床研究使用在研药物或安慰剂,其他的治疗选择明显增多;临床试验设计的复杂性增加;筛选患者失败率增加。
尤其第二点原因容易被忽略。新药的涌现增加了医生和患者的选择空间,但同时也降低了他们进入安慰剂对照研究的意愿,尤其是不提供长期扩展的二期试验。传统治疗失去响应的患者,一般会寻求新药,但在便宜、可及的生物类似药面前也有了更多的选择。生物制剂的大量应用也使得招募没有生物制剂治疗史的患者越来越困难。此外,试验流程中需要一定的洗脱期(通常5个半衰期),这对于超长半衰期的生物制剂来说,无疑会使患者长期暴露在无药控制或使用激素等其他药物的状态下,导致不少患者望而却步。
尽临床前评价模型转化效率低
动物模型是探索疾病发生机制,并为治疗效果提供概念验证的重要工具。然而,胃肠道系统中宿主遗传和环境因素独特的相互作用使建立IBD替代物种的模型非常具有挑战性。即使比较成熟的结肠炎模型也会受到重复性问题的困扰,这可能部分归因于不同实验室条件下微生物的差异。尽管如此,临床前动物模型仍然在为IBD病理生理机制及治疗评价研究“任劳任怨”地服务。
已经有多种IBD小鼠模型,从化学诱导的结肠炎模型到基因模型再到免疫改造或特殊菌群添加的模型。可是,至今没有一个模型能充分预测治疗的结果。每一种体内模型都有其适用性,稳健的科学研究关键仍然是谨慎地选择正确的模型来解决对应的科学问题,而不是将其直接转化为临床疗效。简单的右旋糖酐硫酸酯钠(DSS)诱导模型以及它所引起的损伤和炎症产生了大量科研论文,但却没有给患者带来直接的益处。例如,已经证明临床疗效的抗TNFα和抗IL-12/23p40抗体在化学诱导的结肠炎模型上是无效的。这可能是因为这些模型还只是短期的急性损伤而不是遗传易感人群发展多年的持续的疾病过程。而在其他模型,比如T细胞转移鼠(幼稚T细胞转移到Rag null或SCID突变小鼠),抗炎治疗却是非常有效的。
但是,即使小鼠对给定的治疗反应一致,但现实中却没有一种治疗方法能充分治疗所有IBD患者,这也表明需要多种模型来探索人类疾病的不同方面。理解哪些模型能充分代表人类疾病的不同方面是理解何时以及如何使用一种模型而不是另一种模型来解决与通路和治疗相关的适当机制问题的关键。
此外,具有显著且常常是严重免疫缺陷的遗传突变的小鼠让我们对IBD的免疫发病机制有了更深入的了解;然而,在这些小鼠身上的发现仅仅带来了少量的治疗方法,帮助了美国200多万以及全世界数百万IBD患者中的一小部分。最近的一个例子是IL -17抗体(Secukinumab)不仅不能对CD患者产生益处,而且还加重了一些患者的症状。动物模型研究发现,白细胞介素-23 (IL-23)促进肠道炎症的关键作用是通过IL-6和IL-17A等炎症介质实现的。与IL-17A在IBD中具有更为复杂的免疫调节作用相一致,其他动物模型的结果也提示IL-17A在IBD中具有保护作用。在活动性克罗恩病中发现12例粪便中IL-17A水平升高,同时克罗恩病患者固有层中分泌IL-23和IL-17A细胞数量增加。2006年,北美IBD遗传学协会在一项全基因组关联研究中首次报道IL-23R与克罗恩病易感性的强基因关联。后来,在独立地全基因组关联研究群组上这种联系的进一步证据被看到,提示IL-23-IL-17轴在疾病发病机制中的作用,并为IL-17A在克罗恩病中的作用提供间接证据。结果,在一项Secukinumab的2期临床试验中,第6周时,Secukinumab治疗未能将CDAI均值较安慰剂降低≥50分,错过了主要终点,并满足了IA中预先指定的无效标准。这项研究被提前终止,结果还表明,IL-17A的抑制可能对一组有炎症客观证据的患者产生不良结果。
另一个类似地例子,尽管对IL10 -/-小鼠发生的自发性结肠炎进行了大量研究,证明了这种抗炎性细胞因子在肠道炎症中的重要性,但21项针对IBD患者的IL-10治疗试验并没有显示出显著的有益效果。这可能是由于IL-10受体的多态性阻碍了这种治疗的有效性,或者是IL-10在体内的不稳定性和短半衰期。但无论如何,在人类IBD的阴性结果证实了动物数据外推到人类的不可预测性。
近来,在模型方面有两个最新进展,一是人源化小鼠模型的开发(人类免疫细胞嫁接到免疫缺陷小鼠),二是外植体的使用或直接从人类IBD患者肠道组织分离的固有层单核细胞(lamina propria mononuclear cells),他们可以让研究人员直接在人类细胞和/或组织上验证疗效,相信可以有效提高临床转化效率。
总结
对于big pharma 来说,立项要考虑的因素很多,包括公司的战略布局、市场营销能力等,产品的价值和风险只是其中一个维度而已,但对于biotech 公司来说,核心项目的选择对公司来说则是生死攸关。这时产品的价值和风险几乎是biotech公司的全部。
结合上述IBD领域的趋势和我们对部分相关biotech公司的了解,我们认为biotech公司在IBD领域立项前应该思考如下几个问题:
一、IBD虽然有较多未满足的临床需求,但自己的产品定位是否属于真正的未满足的临床需求?如果是,这个需求有多大?比如:我们认为对于一个biotech公司,如果单纯改变给药途径面临的风险将较大,可能不足以支持其管线的商业价值。安全性和依从性甚至包括疗效的组合提升才是创业公司更好的选择。
二、IBD领域随着新药的涌现,市场放量会放缓甚至未被占据的市场份额都在萎缩,新产品尤其是发挥核心作用的新MOA产品的立项需要考虑这些变化,是否还有较大把握从现有“鱼塘”中捕获足够的“鱼”?相反,围绕核心地位产品的联合治疗(比如低毒的局部的粘膜或屏障修复或维持药物)或者围绕安全性或顺应性的深度挖掘是否可能另辟蹊径?
三、临床资源也在快速萎缩,是否有足够的能力、资金和时间来运作一个较大规模的临床研究?如何更巧妙的设计临床试验,以为上市后产品增加竞争力?
四、IBD领域临床前评价模型与临床结果之间关联性较弱,如何选择合适的临床前评价模型?对于新的MOA,如果能有临床上biomarker的指征,或全新的药物发现技术,将可能提高新产品的研发成功率。
未来最有价值的IBD新药将符合以下特征中的一个或几个:
1、全新机制,能够较大比例地解决现有药物无法诱导达到完全缓解的患者或者难治性/复发性患者。
2、解决现有药物的依从性和安全性等问题,扩大治疗窗。
3、诱导缓解并且能够达到“深度缓解”。
4、加速缓解或提高预后的辅助治疗或联合治疗。
参考
[1]AGA Clinical Practice Guidelines on the Management of Moderate to Severe Ulcerative Colitis. [Epub ahead of print] Gastroenterology. 2020 Jan 13. DOI: 10.1053/j.gastro.2020.01.006
[2]AGA Technical Review on the Management of Moderate to Severe Ulcerative Colitis. [Epub ahead of print]. Gastroenterology. 2020 Jan 13. doi: 10.1053/j.gastro.2020.01.007.
[3]The IBD Therapeutic Pipeline is Primed to Produce. PRACTICAL GASTROENTEROLOGY
[4]Genentech Research and Early Development (gRED).
https://www.roche.com/dam/jcr:46f31db2-73e5-4129-b1c4-e2d72233af5d/en/irp20200218.pdf
[5]Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. The Lancet, 390(10114), 2769–2778. doi:10.1016/s0140-6736(17)32448-0
[6]Discontinuation of Infliximab in Patients With Ulcerative Colitis Is Associated With Increased Risk of Relapse: A Multinational Retrospective Cohort Study. Clinical Gastroenterology and Hepatology, 14(10), 1426–1432.e1. doi:10.1016/j.cgh.2016.05.044
[7]IM-UNITI: 3 Year Efficacy, Safety, and Immunogenicity of Ustekinumab Treatment of Crohn's Disease. J Crohns Colitis 2019. doi:10.1093/ecco-jcc/jjz110
[8]The Present and Future of Inflammatory Bowel Disease Treatment.Gastroenterology & Hepatology Volume 12, Issue 7 July 2016
[9]Ustekinumab as Induction and Maintenance Therapy for CD. N Engl J Med 2016;375:1946-60. DOI: 10.1056/NEJMoa1602773.
[10]Ustekinumab as Induction and Maintenance Therapy for UC. N Engl J Med 2019;381:1201-14. DOI: 10.1056/NEJMoa1900750.
[11]Personalising medicine in inflammatory bowel disease—current and future perspectives. Transl Pediatr 2019;8(1):56-69. doi: 10.21037/tp.2018.12.03
[12]Heterogeneity in Definitions of Endpoints for Clinical Trials of Ulcerative Colitis: A Systematic Review for Development of a Core Outcome Set. Clinical Gastroenterology and Hepatology, 16(5), 637–647. doi:10.1016/j.cgh.2017.08.025
[13]Ulcerative Colitis: Clinical Trial Endpoints Guidance for Industry
[14]A Treat-to-Target Update in Ulcerative Colitis: A Systematic Review. Am J Gastroenterol 2019;114:874–883. https://doi.org/10.14309/ajg.0000000000000183
[15]Competition for clinical trails in IBD. Gastroenterology 2019;157:1457–1461. https://doi.org/10.1053/j.gastro.2019.08.020
[16]Challenges in IBD 2019. 2019 Crohn’s & Colitis Foundation
微众银行作为唯一受邀的中国金融机构出席论坛,其企业数字营销部副总经理郑文琛在“引领中小企业全生命周期...
 2024-09-26
2024-09-26从最初帮助中小企业降低进入全球贸易的门槛,到借助全球生态伙伴网络助力企业拓展市场,再到通过供应链融资...
 2024-09-26
2024-09-269月20-22日,长江商学院EMBA29期校友齐聚郎酒庄园四渡赤水教学中心,共同开展8周年返校活动。
 2024-09-25
2024-09-259月24日,第二十四届中国国际工业博览会的帷幕缓缓拉开,世界500强企业美的集团携旗下光伏产业精彩亮...
 2024-09-25
2024-09-25投资家网(www.investorscn.com)是国内领先的资本与产业创新综合服务平台。为活跃于中国市场的VC/PE、上市公司、创业企业、地方政府等提供专业的第三方信息服务,包括行业媒体、智库服务、会议服务及生态服务。长按右侧二维码添加"投资哥"可与小编深入交流,并可加入微信群参与官方活动,赶快行动吧。

2016年注册于北京的中氢新能技术有限公司,下设位于大兴的装备制造公司、位于海淀区的技术研究院、材料...
一度无比高光的理想汽车,猝不及防遭遇重挫。
2024年1月10日,由投资家网主办,财经锐眼、有时间协办,北京微金科技有限公司承办的“第十二届股权...
2024年1月10日,由投资家网主办,财经锐眼、有时间协办,北京微金科技有限公司承办的“第十二届股权...
2024年1月10日,由投资家网主办,财经锐眼、有时间协办,北京微金科技有限公司承办的“第十二届股权...